登记号:CTR20201340
泽布替尼,是中国百济神州自主研发的抗癌药。作为一款本土研发的新型强效BTK抑制剂,泽布替尼经过分子结构的优化,能对BTK靶点形成完全、持久的精准抑制。
泽布替尼是一款强效BTK抑制剂,作为单药或与其他疗法联合用药,在多种淋巴瘤治疗中开展临床试验。
2019年11月15日,美国食品药品监督管理局(FDA)宣布,“泽布替尼”以“突破性疗法”的身份,“优先审评”获准上市。实现中国抗癌新药出海“零的突破”,随后其陆续在中国、加拿大、澳大利亚、俄罗斯、欧盟等多个国家和地区获批上市,其商业化足迹已遍布全球44个市场。
百悦泽共有三项已获批的适应症纳入国家医保目录,覆盖既往至少接受过一种治疗的套细胞淋巴瘤(MCL)、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)和华氏巨球蛋白血症(WM)患者。
2021年6月11日举行的26届欧洲血液学协会年会(EHA 2021)网络大会的主席研讨会上,百济神州发布的一项全球头对头3期临床研究最新数据表明:该公司自主研发的抗癌新药泽布替尼(商品名“百悦泽”),以更好的疗效和安全性,在数据上优胜强生公司研发的抗癌药伊布替尼。这是中国创新药首次在头对头中打败欧美跨国公司药物。
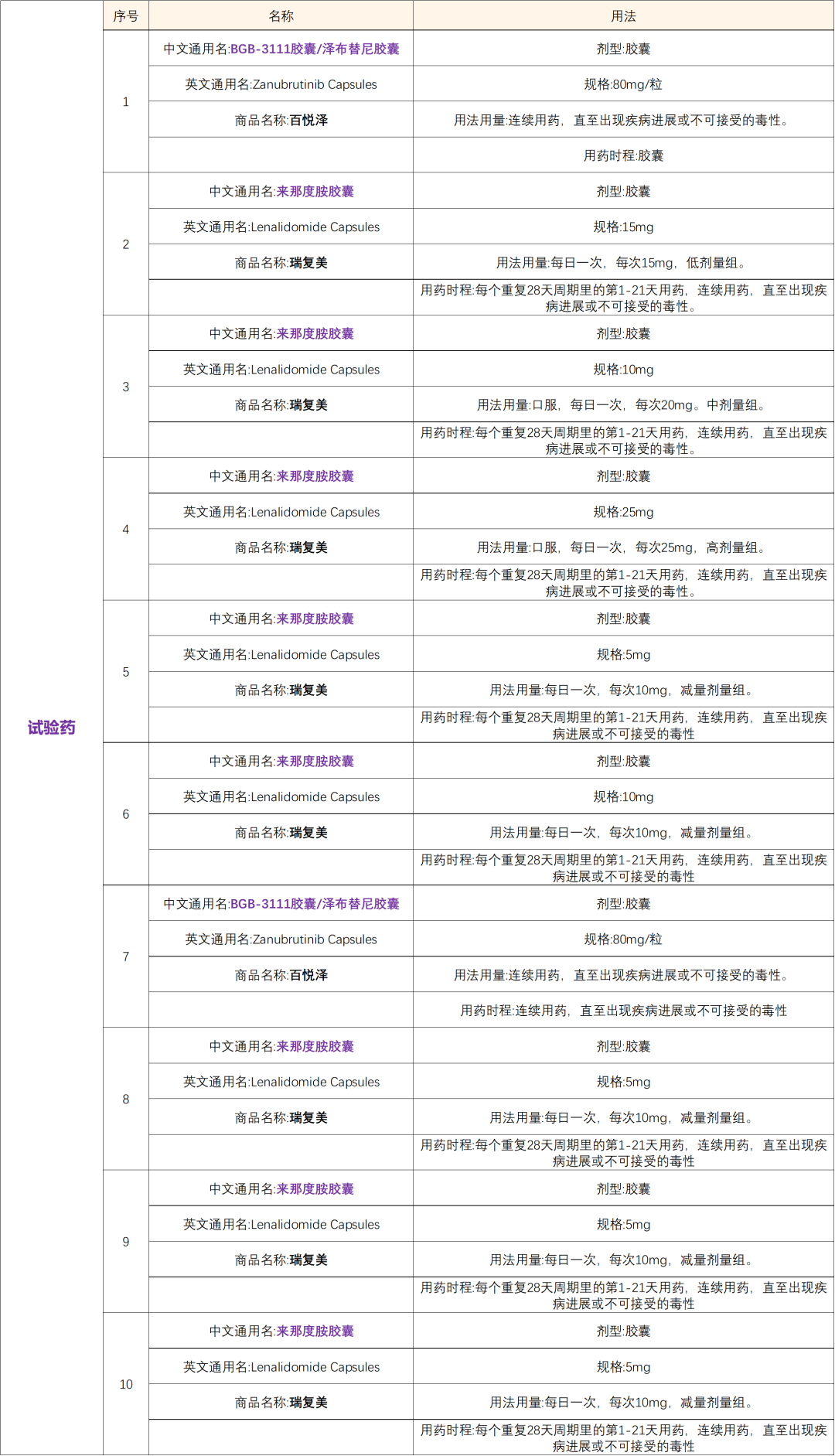
通俗题目:泽布替尼联合来那度胺,联/不联用利妥昔单抗治疗淋巴瘤
 信息来源:百度百科
信息来源:百度百科
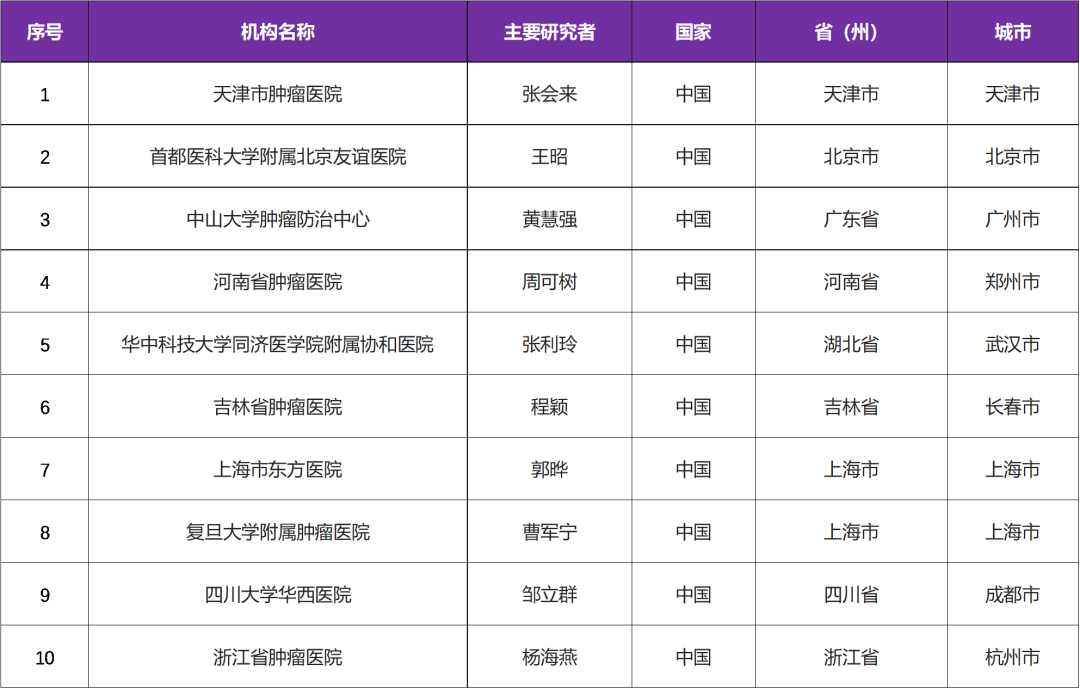
本次临床试验国内主要研究者由 天津市肿瘤医院张会来教授 牵头,该试验是国内多中心试验,参研机构有国内 10 家医院
【简要入排】:
1.年龄≥18岁,男女不限;ECOG体能状态评分为0-2分3. 未接受过高剂量治疗/干细胞移植(HDT/SCT)的受试者必须为不适合HDT/SCT的受试者。4.可测量病灶定义为至少有1个淋巴结病变的最长径>1.5 cm,或至少有一个结外病变最长径 > 1.0cm,而且至少有2个可以准确测量的垂直径。5.先前接受过至少一线适当的针对DLBCL的系统性治疗,适当的针对DLBCL的系治疗定义为含有抗CD20抗体和蒽环类为基础的联合治疗至少2个周期,除非患者不耐受或者在2个周期内疾病进展。1.有中枢神经系统(CNS)淋巴瘤;组织学转化的大细胞淋巴瘤。3.接受过BTK抑制剂治疗;接受过来那度胺或沙利度胺治疗。
三、参研中心(知名三甲医院)
以上信息来自国家药品监督管理局药品审评中心,网址为http://www.chinadrugtrials.org.cn
登记号:CTR20201340 即可查询
