
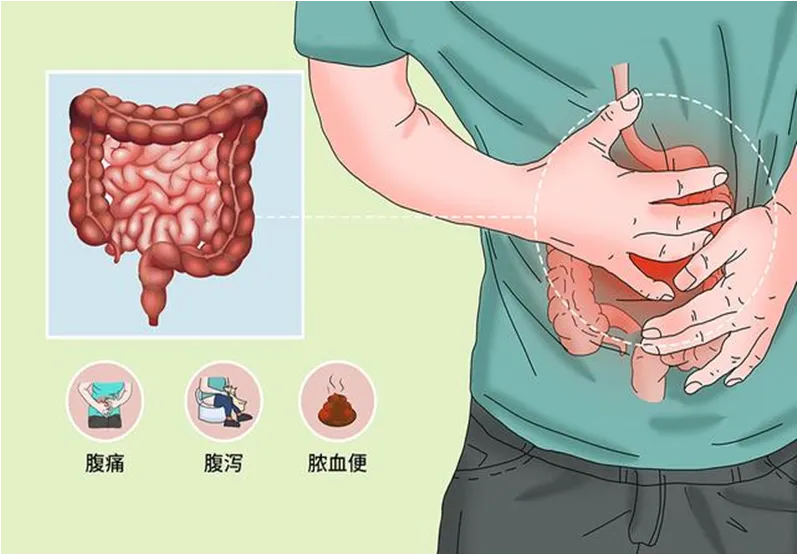
Ø慢性非特异性肠道炎症性疾病,主要累及直肠和结肠,多呈反复发作
Ø中国UC患病率为11.6/10万人
Ø最常发生于青壮年期,我国高发年龄为20岁~49岁,性别差异不明显
Ø持续或反复发作的腹泻、黏液脓血便,伴腹痛、里急后重和不同程度的全身症状,病程多在4~6周以上
Ø治愈难度大、复发率高、且有癌变的可能

Ø作用机制:全人源抗IL-23单克隆抗体,能以高特异性亲和力与人IL-23的p19蛋白亚基结合,阻断细胞外IL-23与细胞表面IL-23受体结合,从而抑制IL-23介导的细胞内信号传递、活化和细胞因子生成
Ø药物优势:
ü国内外上市药,国内获批治疗银屑病
ü暂未进医保,患者经济获益大
ü在治疗溃疡性结肠炎患者中有既往2b期研究数据支持
2022年第17届欧洲克罗恩病和结肠炎组织(ECCO)大会上公布的2b期QUASAR诱导研究结果:
在对常规疗法和/或选定的进阶疗法应答不足或不耐受的中重度活动性UC成人患者中,治疗第12周,与安慰剂组相比,古塞奇尤治疗组有显著更高比例的患者达到临床反应(古塞奇尤单抗200mg静脉治疗组:61.4%;古塞奇尤单抗400mg静脉治疗组:60.7%;安慰剂组:27.6%)
适应症:溃疡性结肠炎(对传统治疗或进阶治疗应答不足)通俗题目:在中重度活动性溃疡性结肠炎受试者中评价古塞奇尤单抗皮下给药诱导治疗的疗效和安全性的III期研究
 信息来源:百度百科
信息来源:百度百科
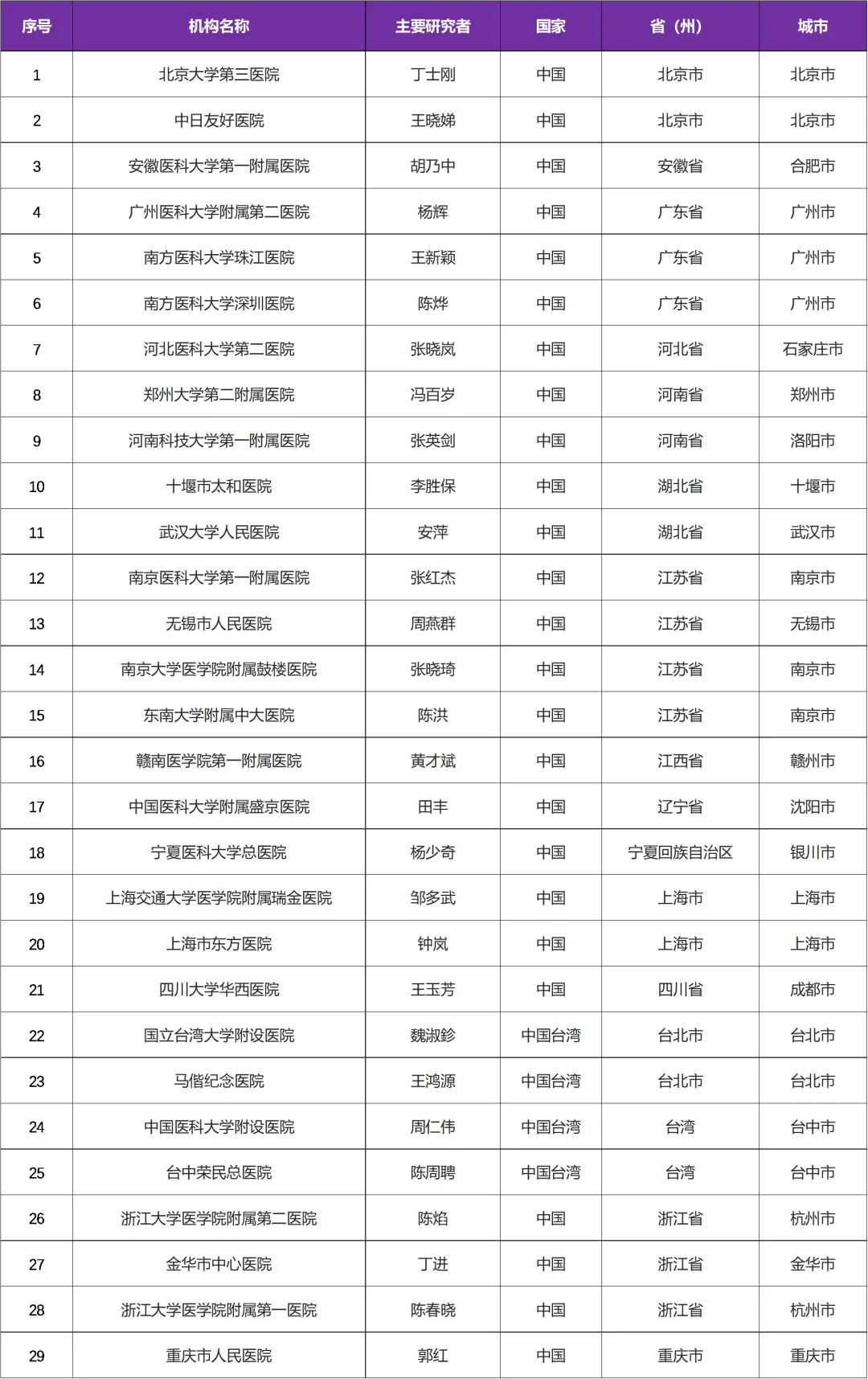
本次临床试验主研中心/研究者: 北京大学第三医院丁士刚教授
中国共有29家医院参研中心(全球229家参研中心)
1.年龄≥18岁
2.在筛选前至少12周有溃疡性结肠炎确诊记录(组织学检查以及内镜或放射学检查)
3.中重度活动性溃疡性结肠炎,定义为基线(第0周)改良Mayo评分为5分-9分(含),采用内镜检查筛选视频的中心审查获得的Mayo内镜检查分项评分判断
4.基线时Mayo直肠出血分项评分≥1
5.筛选视频内镜中心审查获得的Mayo内镜分项评分≥2
6.有≥8年广泛性结肠炎病史或≥10年左侧结肠局限性结肠炎病史的受试者,必须在研究药物首次给药前1年内接受完整的结肠镜检查以评估是否存在异型增生,或在筛选访视时接受完整的结肠镜检查以评估是否存在恶性肿瘤
7.年龄≥45岁的受试者必须在研究药物首次给药前5年内或在筛选访视时进行完整的结肠镜检查以评估是否存在腺瘤性息肉。必须在研究药物首次给药前切除腺瘤性息肉
3.诊断为未定型结肠炎、显微镜下结肠炎、缺血性结肠炎或克罗恩病,或有提示克罗恩病的临床结果
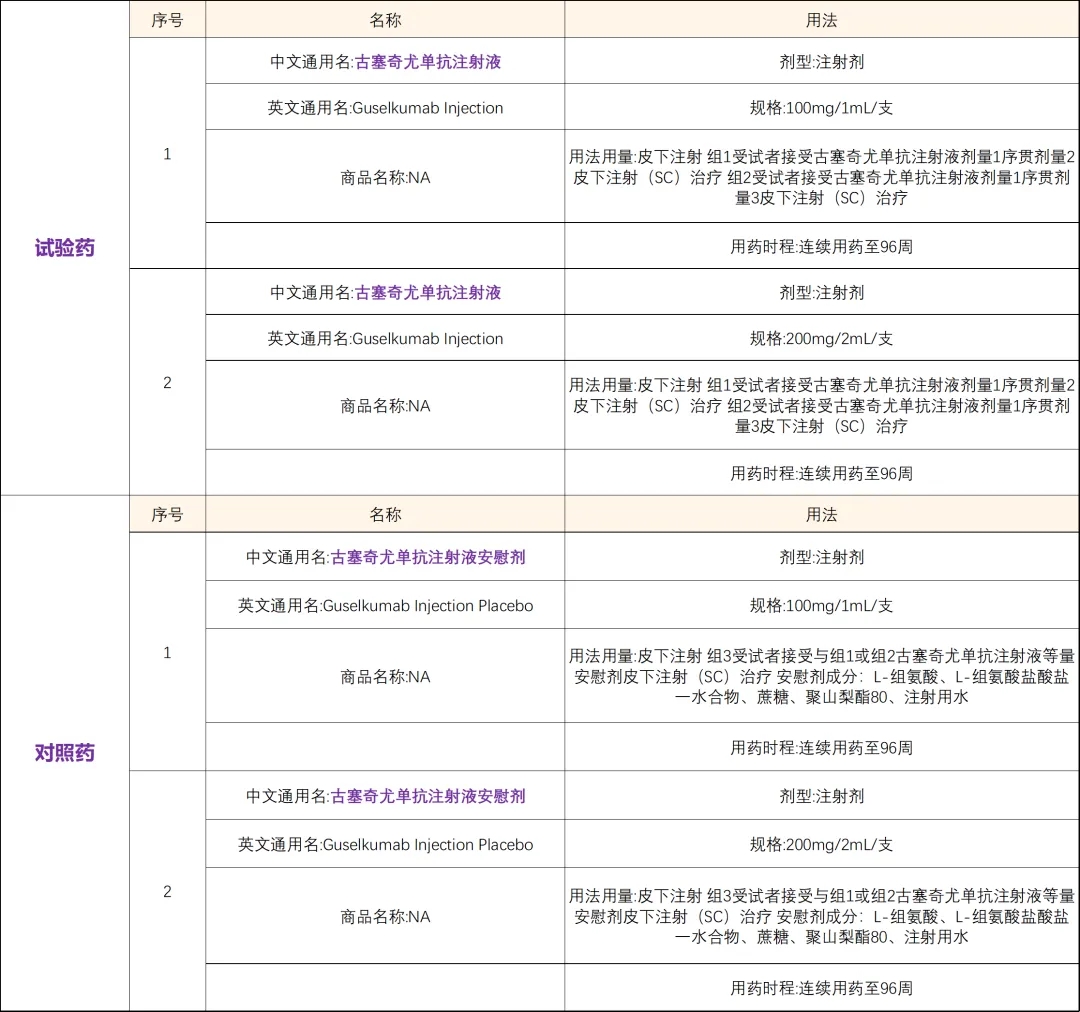
Ø安慰剂组患者在第16周时符合补救标准,可接受补救治疗,即第16、20和24周接受古塞奇尤单抗400mg给药,随后分配进q8w治疗组
Ø所有完成第24周访视且研究者认为可从研究药物中获益的受试者均有资格进入72周的研究延长期,第48周评估后揭盲,未接受古塞奇尤单抗补救治疗的安慰剂组患者将终止研究
三、国内参研医院
以上信息来自国家药品监督管理局药品审评中心,网址为http://www.chinadrugtrials.org.cn
登记号:CTR20223406即可查询
