关键词:强直性脊柱炎;IL-17 靶点抗体药物;Ⅲ期

(获取最新招募信息,点击关注)
科普:
强直性脊柱炎(ankylosing sporidylitis,AS)是一种主要侵犯脊柱,并可不同程度的累及骶髂关节和周围关节的慢性进行性炎性疾病。本病又名Marie-strümpell病、Von Bechterew病、类风湿性脊柱炎、畸形性脊柱炎、类风湿中心型等,现都称AS。AS的特点为腰、颈、胸段脊柱关节和韧带以及骶髂关节的炎症和骨化,髋关节常常受累,其它周围关节也可出现炎症。
重庆智翔是一家创新驱动型生物制药企业,主营业务为抗体药物的研发、生产与销售,在研产品为单克隆抗体药物和双特异性抗体药物。
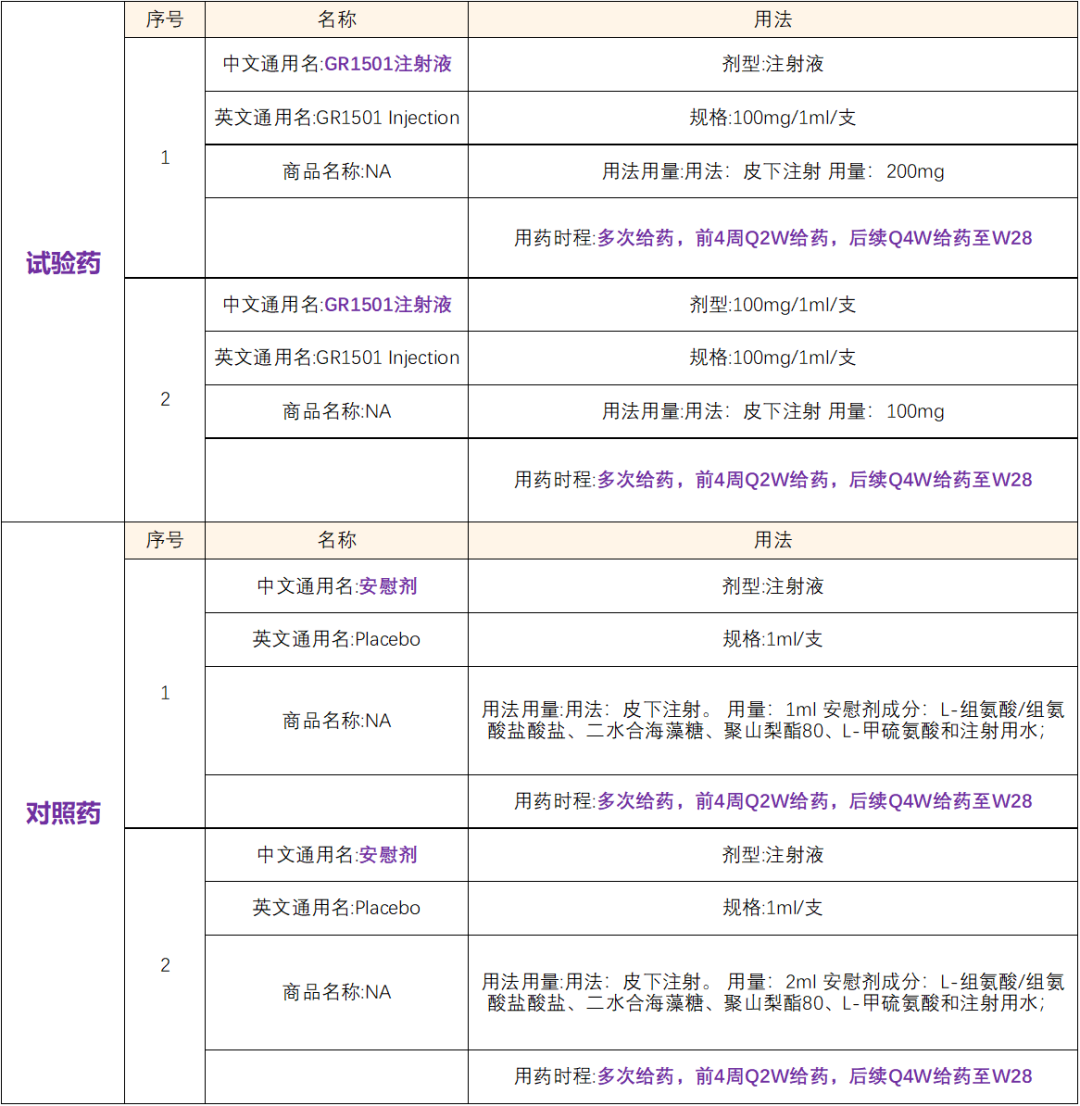
GR1501注射液是一种重组全人源化抗白介素17A单克隆抗体,通用名为赛立奇单抗(Xeligekimab),主要适应症为中重度斑块状银屑病和中轴型脊柱关节炎等,其中中重度斑块状银屑病适应症预计在2024年初获批上市,中轴型脊柱关节炎适应症预计在2025年获批上市。
在已经上市药品中,IL-17 靶点抗体药物是目前治疗银屑病最好的药物之一。此外,IL-17A靶点抗体药物对中轴型脊柱关节炎也有着良好的治疗效果,在已经上市药品中,IL-17靶点抗体药物的16周临床疗效与抗TNF-α抗体药物相当。
根据流行病学数据,我国有银屑病患者约570万人,中轴型脊柱关节炎成年人患者约560万人,IL-17靶点抗体药物对上述疾病有着良好的治疗效果。2019年以来,IL-17靶点抗体药物司库奇尤单抗、依奇珠单抗和布罗利尤单抗陆续在国内上市。
临床前数据结果显示,GR1501注射液具有更高选择性和潜在更佳安全性,有望为患者提供更安全有效的新型治疗方案。
企业信息:重庆智翔金泰生物制药有限公司/ 智翔(上海)医药科技有限公司适应症:中轴型脊柱关节炎(包括强直性脊柱炎、牛皮癣关节炎、炎症性肠病性关节炎、反应性关节炎等)试验专业题目:一项评价 GR1501 注射液在放射学阳性中轴型脊柱关节炎患者中有效性和安全性的随机、双盲、安慰剂对照的Ⅲ期临床试验

信息来源:百度百科
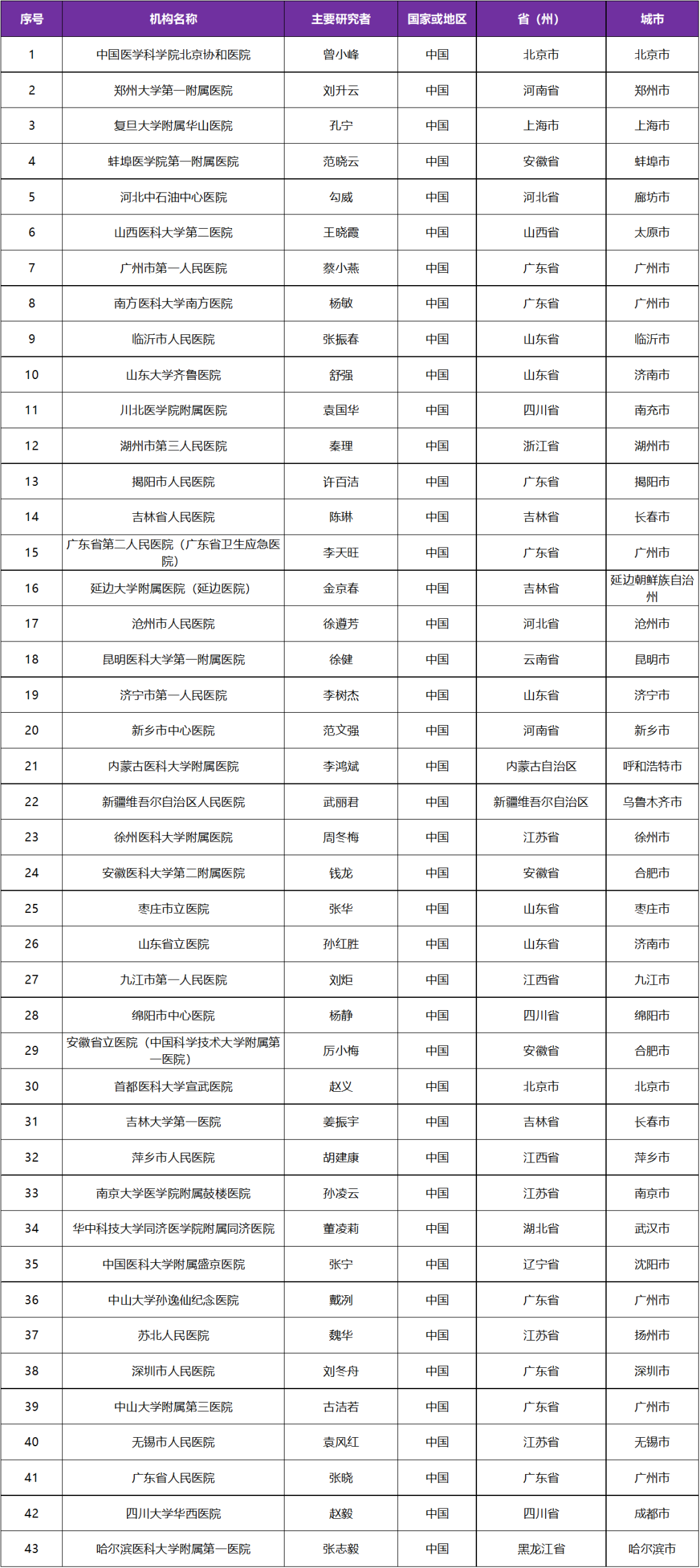
本次临床试验国内主要研究者由中国医学科学院北京协和医院曾小峰医学博士牵头,该试验是国内多中心试验,参研机构有国内 43 家医院
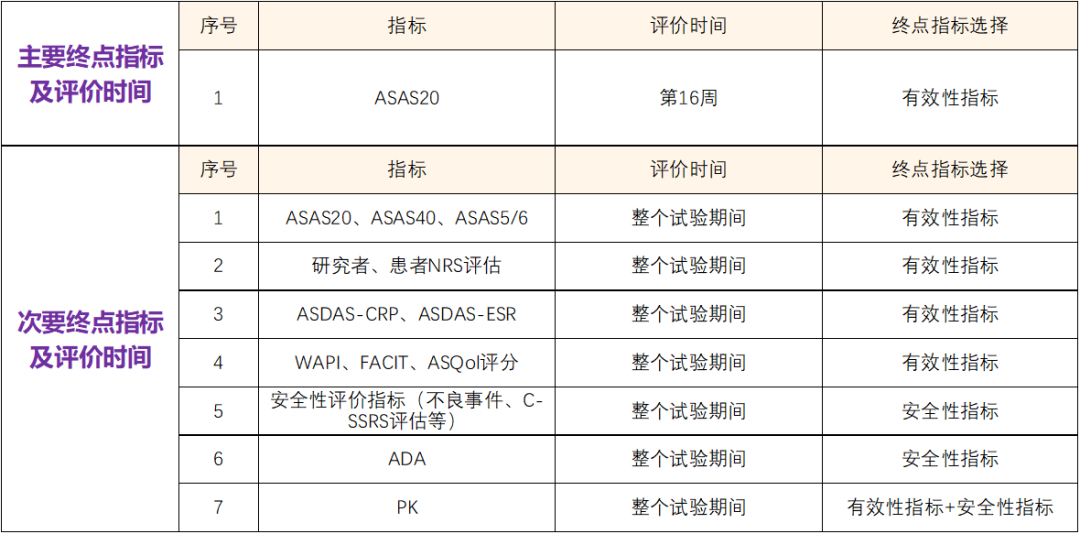
主要目的:评价GR1501注射液治疗放射学阳性中轴型脊柱关节炎患者疗效;评价GR1501注射液治疗放射学阳性中轴型脊柱关节炎患者安全性特征;评价GR1501注射液治疗放射学阳性中轴型脊柱关节炎患者免疫原性;评价GR1501注射液在放射学阳性中轴型脊柱关节炎患者中皮下给药PK特征。
【简要入排】:
1、年龄≥18岁,无上限,男女不限
2、符合国际脊柱关节炎评价工作组(ASAS)中轴型脊柱关节炎(axSpA)诊断(诊断标准详见附件2),且骶髂关节炎影像学改变符合纽约改良标准(详见附件3):双侧骶髂关节炎≥2级或单侧骶髂关节炎3~4级
3、必须符合下列要求:
1)筛选和随机前Bath强直性脊柱炎疾病活动指数(BASDAI)≥4分且脊柱痛评分≥4分;
2)既往对非甾体抗炎药(NSAIDs)药物治疗反应欠佳(既往使用1种NSAIDs推荐剂量下使用≥4周或既往使用≥2种NSAIDs,每种NSAIDs使用≥2周);或对NSAIDs有禁忌症或无法耐受;
3)如受试者正在口服NSAIDs或其他镇痛药(如对乙酰氨基酚或其他弱阿片类药物),随机前需稳定剂量持续≥2周;如受试者未稳定口服上述药物,随机前至少停药≥2周;
4)如受试者正在接受口服糖皮质激素治疗者,随机前剂量需满足强的松≤10mg/天(或者与强的松剂量相当剂量的其它糖皮质激素),且剂量稳定≥2周;如受试者未口服糖皮质激素,随机前至少停药≥4周;
5)如受试者正在口服甲氨蝶呤(7.5-25mg/周)或柳氮磺胺吡啶(≤3g/日)或羟氯喹(≤400mg/天),随机前需持续治疗≥3个月,且稳定剂量持续≥4周;如受试者未稳定剂量口服上述药物,随机前至少停药≥4周;

【试验分组】:
随机 双盲 平行分组 国内试验 Ⅲ期
【治疗/干预方法】
试验组:GR1501注射液 赛立奇单抗(Xeligekimab)
用药方案:
【终点指标】
三、参研中心(知名三甲医院)
以上信息来自CDE平台,网址为http://www.chinadrugtrials.org.cn
输入编号为:CTR20220952 即可查询
